求学问校网小编为大家整理了2021年湖北自考物理化学(二)考试大纲以及部分样题,大家一起来看看吧!

考核内容与考核目标
第一章 化学热力学基础
一、学习目的与要求
1、使学生了解热力学的有关概念、热力学第一定律及其应用、可逆过程的特征、几种反应热的概念、熵的有关概念。
2、要求学生能运用热力学第一定律进行热、功、热力学能及焓的改变量的计算,化学反应热的计算。
3、深刻理解热力学第二定律,熟练掌握熵的改变量的计算以及熵增加原理的应用。
二、考核知识点与考核目标
(一)热力学的有关概念、热力学第一定律及其应用、会计算热、功、热力学能、焓、熵等物理量的表示方法、运算公式及化学反应热的计算(重点)
识记:体系与环境、状态与状态函数、热和功、定压热与定容热、相变热、热容、热力学能、焓、热化学方程式、标准摩尔生成焓、标准摩尔燃烧焓、熵等物理量的表示方法、运算公式及化学反应热的计算。
理解:热力学第一定律、状态函数的性质、可逆过程的特点、盖斯定律、热力学第二定律、自发过程的特点、熵增加原理、理想气体Cp,m与Cv,m的关系
应用:会计算理想气体简单状态变化过程中热、功、热力学能、焓、熵的改变量;可逆相变过程中相变热,熵变的计算;化学反应的反应热及熵变的计算;熵判据的应用。
(二)(次重点)
识记:热温熵、热机效率、热容与温度的关系、标准状态
理解:理想气体的绝热可逆过程、反应热与温度的关系、Carnot循环与Carnot定理
应用:对不可逆相变过程设计成可逆过程计算相变热及熵变
(三)(一般)
识记:物质的规定熵、标准熵;真实气体状态方程
理解:焦耳实验、热力学第三定律、热力学的优势和局限性
应用:利用公式计算不同温度下的反应热;可逆体积功的计算;节流膨胀
第二章 自由能、化学势和溶液
一、学习目的与要求
1、使学生了解吉布斯自由能、亥姆霍兹自由能概念、掌握ΔG的计算以及用ΔG来判断反应进行的方向。
2、深刻理解理想气体和理想溶液的含义,熟记理想溶液的通性。
二、考核知识点与考核目标
(一)吉布斯自由能、亥姆霍兹自由能概念、掌握ΔG的计算以及用ΔG来判断反应进行的方向。(重点)
识记:吉布斯自由能、亥姆霍兹自由能、理想气体与理想溶液。
理解:吉布斯自由能判据、亥姆霍兹自由能判据、拉乌尔定律、亨利定律、理想溶液的通性。
应用:简单的P,V,T变化过程ΔG计算、相变过程ΔG计算、化学反应ΔG计算、用ΔG来判断反应进行的方向、理想溶液的通性。
(二)(次重点)
识记:偏摩尔量、化学势
理解:偏摩尔量的定义、理想气体和理想溶液中的化学势。
应用:化学势判据。
(三)(一般)
识记:热力学的基本关系式、熵与克劳修斯不等式.热力学基本方程、克拉佩龙-克劳修斯方程
理解:吉布斯自由能随温度、压力的变化
应用:计算不同温度下各种过程的△S、△A及△G的计算
第三章 相平衡
一、学习目的与要求
1、使学生了解相律的有关概念、相律的应用。
2、要求学生能用相律分析单组分水的相图。
3、深刻理解二组分体系中某些相图的重要用途,利用一些特殊的相图分离提纯物质。
二、考核知识点与考核目标
(一)相律的有关概念、典型的一些单组分相图和二组分双液体系相图(重点)
识记:相与相数、独立组分数、物种数、自由度物系点、相点、杠杆规则。
理解:相律的表达式、Clapeyron方程、水的相图, P-x图、T-x图、精馏原理、水-硫酸铵相图
应用:用相律计算某平衡体系中的相数/独立组分数/物种数/自由度、用相律分析水的相图,指出图上点、线、面的相态及自由度、用Clapeyron方程计算一定温度下的蒸气压和某一确定蒸气压下液体的沸点、计算蒸发热、用杠杆规则计算二相共存时,二相的相对质量、组分理想液态混合物气液相图、杠杆规则、二组分液固相图分析
第四章 化学平衡
一、学习目的与要求
1、使学生了解化学平衡的基本原理、反应进度与反应限度的关系。
2、要求学生能掌握化学反应定温式以及进行与标准平衡常数有关的计算。
3、深刻理解影响化学平衡的因素并在生产上加以应用。
二、考核知识点与考核目标
(一)化学平衡的基本原理、化学反应定温式、与标准平衡常数有关的计算、平衡体系中成分含量的计算(重点)
识记:化学平衡、反应进度、反应限度、化学反应定温式、标准平衡常数。
理解:标准平衡常数Kө与反应ΔrGөm的关系、影响化学平衡的因素。
应用:平衡常数计算、用化学反应定温式判断化学反应的方向、温度对平衡常数的影响。
(二)(次重点)
识记:多相反应的平衡常数。
理解:多相平衡。
应用:多相反应的标准平衡常数的测定、计算生产中的产率。
(三)(一般)
识记:平衡常数的测定方法、标准摩尔反应吉布斯函数的计算
理解:反应进度与反应限度的关系
应用:平衡体系中成分含量的计算、同时反应平衡组成的计算、真实气体反应化学平衡
第五章 电解质溶液
一、学习目的与要求
1、使学生了解电解质导电的原理及其有关概念。
2、要求学生能掌握对电解质导电能力的分析并进行有关计算。
3、深刻理解电导测定在实际生产中的应用。
二、考核知识点与考核目标
(一)电解质导电的原理及其有关概念、电解质导电能力的有关计算、电导在实际生产中的应用(重点)
识记:电导、电导率、摩尔电导率、离子摩尔电导率。
理解:电解质溶液的导电机理、摩尔电导率与离子浓度的关系、离子独立运动定律、H+和OH-的无限稀释摩尔电导率特别大的原因。
应用:电导和电导率的计算、摩尔电导率的计算、电导池常数的计算、用强电解质的无限稀释摩尔电导率计算弱电解质的无限稀释摩尔电导率、电导测定的应用。
(二)(次重点)
识记:活度、活度系数。
理解:电导的测定方法、影响离子平均活度系数的因素。
应用:离子平均活度a±及平均浓度m±的计算。
(三)(一般)
识记:离子迁移数、法拉第定律、离子淌度、离子迁移数、法拉第定律
理解:离子迁移数的定义、离子迁移数与淌度间的关系
应用:离子迁移数的计算、电导率、摩尔电导率关系及计算、电导测定对解离平衡常数的应用
第六章 可逆电池电动势
一、学习目的与要求
1、使学生了解可逆电池有关概念和可逆电极的类型及电极反应。
2、要求学生能掌握电池的书写方式、根据化学反应设计原电池、原电池的有关热力学计算、用能斯特公式计算电极电势。
3、深刻理解电池电动势以及电极在实际生产中的应用。
二、考核知识点与考核目标
(一)可逆电池有关概念和四类可逆电极(重点)
识记:可逆电池、四类可逆电极、氢电极、甘汞电极、电池书写方式。
理解:可逆电池所具备的条件、电池的书写方式、能斯特公式、四类可逆电极的书写表达式和电极反应及电极电势。
应用:由电池表示式写出电极反应及电池反应、电动势与平衡常数的计算、电动势测定的应用、电动势的计算及应用。
(二)(次重点)
识记:标准电池。
理解:电池电动势的产生、对消法测电动势的原理、。
应用:设计原电池。
(三)(一般)
识记:标准电池、玻璃电极
理解:氢电极、甘汞电极、玻璃电极测定溶液pH值的原理及计算pH值、玻璃电极的原理
应用:特殊电极的应用、电化学计算及应用、电动势与电池反应热力学函数间关系。
第八章 化学动力学
一、学习目的与要求
1、使学生了解化学动力学的基本概念及原理。
2、要求学生能掌握化学动力学中有关参数的计算。
3、深刻理解两个解释化学反应速率的理论。
二、考核知识点与考核目标
(一)化学动力学的基本概念及原理、化学动力学中有关参数的计算(重点)
识记:反应分子数、化学反应速率、基元反应、复合反应、反应级数、反应分子数、速率常数、活化能、催化剂。
理解:质量作用定律、一级反应速率方程的积分式、温度对反应速率的影响、Arrhenius公式、催化剂的基本特征。
应用:一级反应速率常数和半衰期计算、活化能的计算、其他化学动力学参数的计算及应用、解释化学反应快慢原因。
(二)(次重点)
识记:两个解释化学反应速率的理论、对峙反应、平行反应、指前因子、碰撞理论、过渡态理论。
应用:求反应的适宜温度。
(三)(一般)
识记:连串反应、典型复合反应、光化学反应
理解:零级/二级反应速率方程的积分式、能级分布的微观状态数。
应用:零级/二级反应速率常数、反应级数判断、反应级数的确定、配分函数的计算、单相催化反应、多相催化反应。
第十章 液体表面
一、学习目的与要求
1、使学生了解液体表面的基本性质。
2、要求学生能掌握基本原理来解释一些表面现象。
二、考核知识点与考核目标
(一)液体表面的基本性质及一些概念(重点)
识记:比表面、比表面自由能、表面张力、表面活性物质。拉普拉斯方程、开尔文方程、.吉布斯等温式
理解:弯曲液面的特征、Laplace公式、表面活性物质的结构。
应用:应用Laplace公式分析液面曲率半径与附加压力的关系。
(二)(次重点)
识记:溶液的表面张力、溶液的表面吸附、杨氏方程
理解: Gibbs吸附等温式。
应用:用Gibbs吸附等温式解释表面吸附现象。
(三)(一般)
识记:胶束、表面活性物质分类。 、朗格缪尔吸附等温式
理解:表面活性物质的HLB值。
应用:用Kelvin公式说明弯曲液面的曲率半径与蒸气压的关系。
第十一章 固体表面
一、学习目的与要求
1、使学生了解固体表面的基本性质。
2、要求学生能掌握基本原理来解释一些固体表面现象。
二、考核知识点与考核目标
(一)固体表面的基本性质及一些概念(重点)
识记:吸附、吸附平衡、物理吸附和化学吸附、接触角、润湿作用。
理解:物理吸附和化学吸附的比较、影响吸附的因素、接触角θ与三个界面张力的定量关系。
应用:吸附作用的应用、比表面的测定。
(二)(次重点)
识记:吸附量、吸附热、、沾湿、浸湿、铺展。
理解:表观吸附量。
应用:解释固体表面吸附的原理。
(三)(一般)
识记:Langmuir定温式。
理解:Langmuir定温式的基本要点。
应用:润湿作用的应用。
第十二章 溶胶
一、学习目的与要求
1、使学生了解溶胶的基本性质。
2、要求学生能掌握基本原理来解释一些表面现象。
二、考核知识点与考核目标
(一)胶体有关的概念、性质(重点)
识记:分散相、分散介质、胶体、溶胶的稳定性与聚沉。溶胶的制备、溶胶的光学性质、溶胶的动力学性质、溶胶的电学性质。
理解:了解溶胶的动力学性质(布朗运动、扩散、沉降);光学性质(Tyndall效应);电学性质(电动现象)。了解溶胶的稳定性与聚沉的原因。
应用:胶团的书写方式、溶胶的扩散与聚沉原理、不同电解质的聚沉值计算。
(二)(次重点)
识记:溶胶的电泳。
理解:溶胶电泳的原理。
应用:溶胶的相互聚沉。
(三)(一般)
识记:电动电势δ。
理解:胶体的双电层结构。
应用:电动电势δ的计算。
第十三章 乳状液与泡沫
一、学习目的与要求
1、使学生了解乳状液的基本性质。
2、要求学生能掌握基本原理来解释现象。
二、考核知识点与考核目标
(一)乳状液的基本性质及一些概念(重点)
识记:乳状液、乳化剂、乳化作用。
理解:乳状液的类型、。
应用:乳状液类型的鉴别。
(二)(次重点)
识记:乳状液的稳定性/转型/破坏。
理解:乳状液的稳定性/转型/破坏原因。
第十四章 高分子溶液
一、学习目的与要求
1、使学生了高分子溶液的基本性质。
2、要求学生能掌握基本原理来解释一些现象。
二、考核知识点与考核目标
(一)高分子溶液的基本性质及一些概念(重点)
识记:高分子化合物、絮凝作用。
理解:高分子溶液/溶胶/小分子溶液的性质比较、高分子对溶胶的影响。
应用:用高分子稳定或絮凝溶胶。
(二)(次重点)
识记:高分子化合物的相对分子量质量。
理解:能指出测定高分子化合物的相对分子量质量用了哪些方法。
应用:能指出高分子对溶胶的絮凝与电解质对溶胶的聚沉有什么不同。
(三)(一般)
识记:高分子化合物形态。
理解:高分子化合物的溶解过程。
第十五章 凝胶及膜平衡
一、学习目的与要求
1、使学生了解凝胶的基本性质。
2、要求学生能掌握基本原理来解释一些现象。
二、考核知识点与考核目标
(一)凝胶的基本性质及一些概念(重点)
识记:凝胶、胶凝作用。
理解:凝胶的结构及其稳定性。
(二)(次重点)
识记:凝胶的性质。
理解:影响胶凝作用的因素。
(三)(一般)
识记:Donnan平衡。
有关说明与实践要求
一、考核的能力层次表述
本大纲在考核目标中,按“识记”、“理解”、“应用”三个能力层次规定其应达到的能力层次要求。各能力层次为递进等级关系,后者必须建立在前者的基础之上,其含义是:
识记:能知道有关的名词、概念、知识的含义,并能正确认识和表述,是低层次的要求。
理解:在识记的基础上,能全面把握基本概念、基本原理、基本方法。能掌握有关概念、原理、方法的区别与联系,是较高层次的要求。
应用:在理解的基础上,能运用基本概念、基本原理、基本方法联系学过的多个知识点分析和解决有关的理论问题和实际问题,是最高层次的要求。
二、教材
1、指定教材:《物理化学》(第五版) 科学出版社 董元彦、路福绥、唐树戈、郑新生主编 ,2015
2、参考教材:
三、自学方法指导
1、在开始阅读指定教材某一章之前,先翻阅大纲中有关这一章的考核知识点及对知识点的能力层次要求和考核目标,以便在阅读教材时做到心中有数,有的放矢。
2、阅读教材时,要逐段细读,逐句推敲,集中精力,吃透每一个知识点,对基本概念必须深刻理解,对基本理论必须彻底弄清,对基本方法必须牢固掌握。
3、在自学过程中,既要思考问题,也要做好阅读笔记,把教材中的基本概念、、原理、方法等加以整理,这可从中加深对问题的认识、理解和记忆,以利于突出重点,并涵盖整个内容,可以不断提高自学能力。
4、完成书后作业和适当的辅导联系是理解、消化和巩固所学知识,培养分析问题、解决问题及提高能力的重要环节,在做联系之前,应认真阅读教材,按考核目标所要求的不同层次,掌握教材内容,在联系过程中对所学知识进行合理的回顾与发挥,注重理论联系实际和具体问题具体分析,解题时应注意逻辑性,针对问题围绕相关知识点进行层次(步骤)分明的论述和推导,明确各层次(步骤)间的逻辑关系。
四、对社会助学的要求
1、应熟知考试大纲对课程提出的总要求和各章的知识点。
2、应掌握各知识点要求达到的能力层次,并深刻理解对各知识点的考核目标。
3、辅导时,应以考试大纲为依据,指定的教材为基础,不要随意增删内容,以免与大纲脱节。
4、辅导时,应对学习方法进行指导,宜提倡“认真阅读教材,刻苦钻研教材,主动争取帮助,依靠自己学通”的方法。
5、辅导时,要注意突出重点,对考生提出的问题,不要有问即答,要积极启发引导。
6、注意对应考者能力的培养,特别是自学能力的培养,要引导考生逐步学会独立学习,在自学过程中善于提出问题,分析问题,做出判断,解决问题。
7、要使考生了解试题的难易与能力层次高低两者不完全是一回事,在各个能力层次中会存在着不同难度的试题。
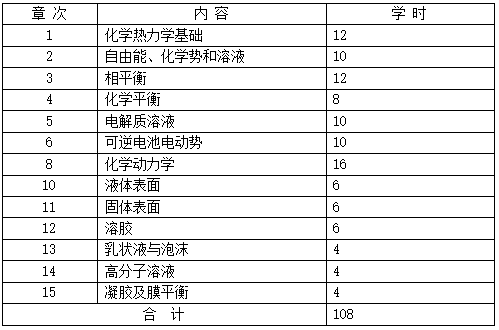
8、助学学时:本课程共6学分,建议总课时108学时,其中助学课时分配如下:
五、关于命题考试的若干规定
1、本大纲各章所提到的内容和考核目标都是考试内容。试题覆盖到章,适当突出重点。
2、试卷中对4个能力层次的试题比例大致是:“识记”为40%、 “理解”为30%、“简单应用”为20%、“综合应用”为10%。
3、试题难易程度应合理:易、较易、较难、难比例为2:3:3:2。
4、每份试卷中,各类考核点所占比例约为:重点占65%,次重点占25%,一般占10%。5、试题类型一般分为:。单项选择题、多项选择题、填空题、名词解释题、简答题、图表分析题、计算题
6、考试采用闭卷笔试,考试时间150分钟,采用百分制评分,60分合格。
六、题型示例(样题)
(一)单项选择题
一个二组分体系,最多共存的相数是( )
A.3相 B.4相 C.5相 D.6相
(二)多项选择题
下列物理量中,属于状态函数的有( )
A. 热 B. 焓 C. 吉布斯自由能 D. 功 E. 热力学能
(三)填空题
某平衡体系内存在以下化学平衡:(1):C(s)+O2(g)=CO2(g);(2):CO(g)+0.5O2(g)=CO2(g);(3):C(s)+0.5O2(g)= CO(g) 此体系的独立组分数K=_____,相数P=________
(四)名词解释题
水的冰点与三相点
(五)简答题
比较高分子溶液和小分子溶液的异同。
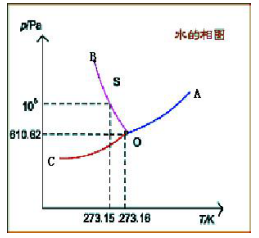
(六)图表分析题
水的相图如下:(1)描述OA,OB,OC三条曲线的意义;(2)写出水的三相点的P和T数据,并与冰点比较,造成这种区别的原因是什么?
(七)计算题
放射性同位素14C 的一级衰变的半衰期是5720年,1974年考古发现一具古尸上裹的亚麻布上14C /12C的比值等于正常值的67.0%。问此尸体大约何时埋葬?
以上就是小编为大家整理的2021年湖北自考物理化学(二)考试大纲以及部分样题,大家要根据考试大纲好好复习。
编辑推荐:









